Vizelet N-acetil-ß-D-glükózaminidáz (NAG-áz) aktivitás meghatározásával vizsgáltuk, hogy van-e összefüggés a diabeteses anyagcsere állapot és a tubulusfunkció korai változása között. 12 diabetes mellitusban szenvedő gyermek (koruk 3-17 év) állapotát követtük a szénhidrát (CH) anyagcsere egyensúly felborulása miatt klinikai kezelést igénylő, majd rendeződő időszakban. A CH anyagcsere állapotának leírásához pontrendszert dolgoztunk ki, melyben a napi inzulin szükséglet/tskg, inzulin típus, vércukor-medián és ingadozás valamint a vesefunkció eltérés szerepelt. A vércukor mérése 2-4 óránként ujjbegyből történt D-Cont készülékkel. A 12 gyermeknél összesen 27 vizeletből NAG-áz aktivitást határoztunk meg, melyet az aktuális vizelet kreatininre vonatkoztattunk (NAG index). A vizelet NAG index/normál tartomány felső határának hányadosa (relatív NAG index) és a diabetesre jellemző összpontszám között lineáris összefüggést találtunk (r: 0,691). Így korai időszakban különböző súlyosságú tubulopathiát tudtunk kimutatni olyan betegeknél, akiknél a hagyományos vesefunkciós érték még normális volt, és mikro-albuminuria általában nem vagy csak jóval később alakult ki.
Kulcsszavak: diabetes, vizelet NAG index, vesefunk-
ció, tubulopathia, CH-anyagcsere
A diabeteses nephropathia az I-es típusú diabetes esetén kb. 40%-os gyakoriságú. Hosszú távon erre utal, ha az albumin (1), transzferrin (2,3), a-1-microglobulin (3), alanin-aminopeptidáz (AAP), gamma-glutamiltranszferáz (GGT) (4) koncentrációja megemelkedik a vizeletben. Klinikai szempontból lényeges, hogy még ennél korábbi, reverzibilis tubuluskárosodás is kimutatható pl. a vizelet N-acetil-ß-D-glükózaminidáz (NAG-áz) aktivitásának mérésével (5,6,7). Ugyancsak követhető így a diaheteses anyagcsere-állapot változásának hatása a vesére.
Az elmúlt évtizedben számos közleményben rámutattak arra, hogy a diabeteses anyagcsere egyensúlyának megbomlásakor a szövet és érrendszert súlyos és gyakori szövődmények érhetik (8,9,10,11,12,13). A diabeteses nephropathia korai felismerése érdekében követtük a vizelet NAG-áz aktivitását klinikai ellátást igénylő gyermekekben a diabeteses krízis kezdetétől annak rendeződéséig.
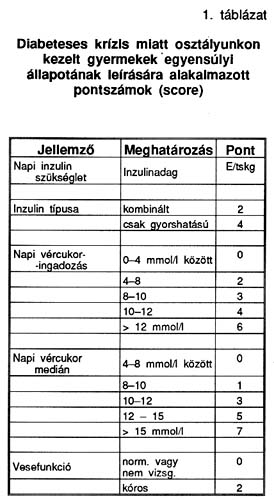
12 diabetes mellitusban szenvedő gyermeket vizsgáltunk a szénhidrát (CH) anyagcsere felbomlása miatt klinikai kezelést igénylő, majd rendeződő időszakban. A lányok: fiúk aránya 7:5, életkoruk 3-17 év, az újonnan diagnosztizált és már gondozott gyermekek megoszlása 6:6. A vizsgálati periódusban egy leánynál MODY (maturity onset diabetes in young) diagnózisát állítottuk fel, a többi gyermek diabetese I. típusú. A CH anyagcsere egyensúlyi állapotának leírásához olyan pontrendszert dolgoztunk ki, amelyben eltekintettünk a gyermekek korától, nemétől, a diabetes típusától, fennállásának idejétől. A következő paramétereket vettük figyelembe: napi inzulinszükséglet, inzulin típusa, napi vércukor ingadozás, vércukor medián és a vesefunkciós értékek. Ezeket az 1. táblázatban jelzett módon súlyoztuk, s a továbbiakban ezt az összpontszámot alkalmaztuk az összevetésben.

Mintavétel a vércukorméréshez 2-4 óránként történt ujjbegy kapillárisból, a meghatározás a gondozásban használatos vércukormérő készülékkel (D-Cont típusok) történt. Mivel a HbA1c érték a CH-anyagcserét hosszú távon jellemzi, ennek változását a krízis során nem, csak az azt követő gondozás során vizsgáltuk. A vesefunkció megítélésére a szérum karbamid és kreatinin meghatározását használtuk. A karbamidot Humán-kittel, a kreatinint módosított Jaffe-módszerrel (14) határoztuk meg.
A korai tubuluskárosodás kimutatására összesen 27 alkalommal történt reggeli első vizeletből NAG-áz aktivitás meghatározás. A napszakonként változó ürítés hatásának kiküszöbölésére a NAG-áz aktivitást az aktuális vizelet-kreatininre vonatkoztatva adtuk meg (NAG index). A vizelet NAG-áz aktivitást p-nitrofenil N-acetil-ß-D-glükózaminid szubsztráttal Horak módszerének (7) módosításával határoztuk meg. A vizeletet -20 oC-on tároltuk, kiolvadás után 5 percig 1000 g-vel centrifugáltuk, a felülúszó 1 ml-ét Sephadex G-25 töltetű oszlopon (8x1,5 cm) gélszűréssel tisztítottuk. A szűrlet 0,5 ml-ét 5 perc előinkubálás után 15 percig 37 oC-on inkubáltuk 0.5 ml pH: 4,4-es citrátpufferben készült 0,1 mmólos szubsztráttal. A reakciót 2 ml 0,1 mólos Na-boráttal leállítva, az enzimaktivitást spektrofotometriásan 400 nm-en határoztuk meg.
Mivel a vizelet NAG index korfüggő, a tubuluskárosodás jellemzésére a NAG index/normál tartomány felső határának hányadosát (relatív NAG index) alkalmaztuk és ennek a diabeteses összpontszámtól való függését vizsgáltuk lineáris regresszió-számítással.
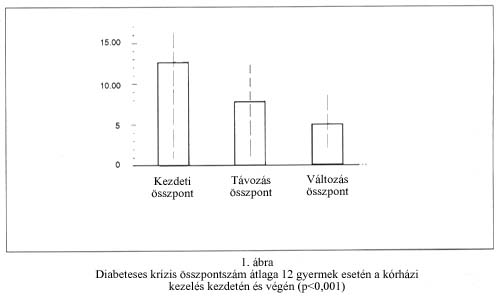
A 12 diabetes mellitusban szenvedő gyermek (koruk 3-17 év) szénhidrát-anyagcsere állapotának jellemzésére a napi inzulinszükségletet, az inzulin típusát, a napi vércukor ingadozást, a napi vércukor mediánt és a vesefunkciós értékeket alkalmaztuk (1. táblázat). Ezeket a táblázatban jelzett módon súlyozottan figyelembe véve egy olyan összpontszámot kaptunk, amely klinikai szempontból jellemző a beteg diabeteses krízis állapotára, a CH anyagcsere zavarára. Ez az összpontszám az általunk vizsgált betegeknél 4,3-18,5 között változott, értéke csökkent a CH-anyagcsere egyensúlyának javulásával.
A 12 betegre vonatkozó pontszám átlaga a kezelés kezdetén mért 12,6±3,7 (SD) értékről 7,69±3,23 (SD) -re csökkent a kórházi kezelés végére, a különbség szignifikáns (p<0,001, párosított t-próba), 1. ábra.
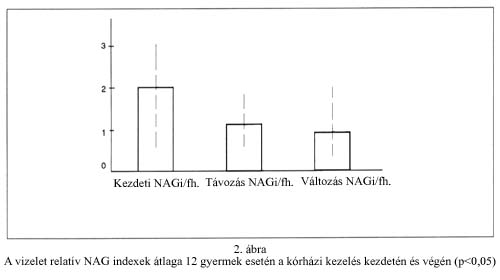
A klinikai kezelést igénylő időszakban (magas, ill. erősen ingadozó vércukor- szintek, változó inzulinigény) követtük a vese tubulusfunkcióra jellemző vizelet NAG-index változását összesen 27 mintából. A relatív NAG index 0,37 - 4,45 között változott; ennek értéke a tubulopathia mértékével nő. Az 1-nél magasabb hányados tubulopathiára utal - miközben mikro-albuminuria még nem volt kimutatható a betegeknél. A relatív NAG index 12 betegre vonatkozó átlaga a kórházi kezelés kezdetén 2 ± 1,28 (SD) volt, ill. 1.1 ± 0,56 (SD) a betegek hazabocsátásakor, amely a CH- anyagcsere egyensúlyával együtt javuló vese tubulusfunkcióra utal (p < 0,05, párosított t-próba), 2. ábra.
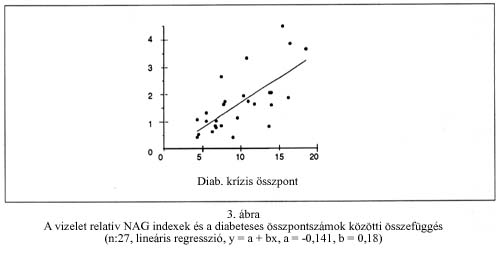
A vizelet relatív NAG indexe és a diabeteses összpontszám között lineáris regresszió számítással r=0,691 korrelációs együtthatójú összefüggést találtunk, melyet a 3. ábrán mutatunk be (y=a+bx, a = - 0,141, b = 0,180).
Az elmúlt két évtizedben vált ismertté, hogy diabetes mellitus esetén mind a szérum, mind a vizelet NAG-áz aktivitás diagnosztikus értékű lehet. A vizelet NAG index hosszabb távon korrelációt mutat a CH anyagcsere állapottal (HbA1C) (15,16,17), a ß-2 mikroalbuminuriával ill. a mikroalbuminuria mértékével, de a NAG index emelkedés jóval korábban észlelhető (18,19). Számos közlemény (6,10,11,12,13) és saját korábbi adataink (9) is azt mutatják, hogy a vizelet NAG-index a diabeteses nephropathia korai stádiumának jellemző paramétere. Már ekkor és a későbbiekben is a CH anyagcsere állapottal szoros összefüggést mutat, amelyet fenti vizsgálatunk is megerősít. Eredményeinkhez hasonlóan az utóbbi években a NAG indexet a CH anyagcsere jellemzőjének és bizonyos tubulusfunkció-eltérés korai paraméterének tekintik, amely már akkor megemelkedik, amikor a nephropathiának még nincs egyéb jele (20), így a tubulusfunkció jellemzésére már a diabetes kezdeti stádiumában napi alkalmazást nyerhet. A beteg állapotváltozásának pontosabb jellemzésére az első egyéni értékhez viszonyíthatjuk a későbbi NAG indexeket. Ezzel jóval előbb (1-2 év) diagnosztikus információt nyerünk a vese helyzetéről, mint a klasszikus mikro-albuminuria vizsgálatával.
Az elmúlt 10 év tapasztalatai szerint a "nehezen beállítható" CH-anyagcsere egyensúlyú betegeknél a vizelet NAG index tartós vagy jelentős mértékű emelkedése az első figyelmeztető jel nemcsak a tubulopathiára, amelyet általában a mikro-albuminuria követ, hanem egyéb vasculáris szövődményekre is. Együttműködő betegnél ez még a reverzibilis tubulopathia esetén jelzés lehet a szorosabb diétakontrollra, a szigorú anyagcsere-ellenőrzésre vonatkozóan. A diabeteses betegek életminőségét nagymértékben befolyásoló veseelégtelenség kialakulásának megelőzésében segítséget nyújt ezen paraméterek követése.
Ezúton mondunk köszönetet az együttműködésért Molnár Tiborné szakasszisztensnek.
Viberti GC, Hill RD, Jarrett RJ, et al..: Microalbuminuria as a predictor of clinical nephropathy in insulin dependent diabetes mellitus Lancet 1982; I: 1430-1432
Cheung CK, Cockram CS, Yeung VTF, et al.:: Urinary excretion of transferrin by non-insulin-dependent diabetics: a marker for early complications? Clin Chem 1989; 35: 1672-1674
Martin P, Walton C, Chapman C, et al.: Increased urinary excretion of transferrin in children with type I diabetes mellitus Diabetic Medicine 1990; 7: 35-40
Feldman D, Flandrois C, Jardel A, et al.: Circadian variations and reference intervals for some enzymes in urine of healthy children Clin Chem 1989; 35: 864-867
Price RG, Whiting PH: Urinary enzymes and nephrotoxicity in humans Urinary Enzymes, Jung K., Mattheiner H., Burchardt U.(Eds) Springer-Verlag. Berlin, Heidelberg, 1992; 203-221.
Watts GF, Vlitos MAJ, Morris RW, et al.: Urinary N-acetyl-ß-Dglucosaminidase excretion in insulin dependent diabetes mellitus: relation to microalbuminuria, retinopathy and glicemic control Diab And Metab 1988; 14: 653-658.
Horak E, Hopfer S, Sunderman FW. Specrophotometric assay for urinary N-acetyl-ß-D-glucosaminidase activity Clin Chem 1981; 27: 1180-1185.
Oláh VA, Csáthy L, Varga J, et al.: Reference ranges for urinary NAG indices in children determined with three colorimetric methods Annals Clin Biochem 1994; 31: 87-88
Oláh VA, Ambró L, Csáthy L, et al.: Urinary N-acetyl-ß-D glucosaminidase activity in diabetic children Acta Paed Hung 1993; 33: 299-308
Minakami H.: Clinical evaluation of N-acetyl-ß-D-glucosaminidase on prediction of diabetic nephropathy Hokkaido-Igaku-Zasshi 1992; 67: 234-246
Agardh CD, Agardh E, Isakson A, et al.: Association between urinary N-acetyl-ß-D-glucosaminidase and its isoenzymes patterns and microangiopathy in type I diabetes mellitus Clin Chem 1991; 37: 1696-1699
Price RG. The role of NAG N-acetyl-ß-D-glucosaminidase in the the diagnosis of kidney disease including the monitoring of nephrotoxicity Clin Nephrol 1992; 38: 14-19
Miltényi M, Körner A, Tulassay T, et al..: Tubular disfunction in type I diabetes' mellitus Arch Dis Child 1985; 60: 929-931
Bonsnes RW, Taussky HH. On the colorimetric determination of creatinine by Jaffe react~on J Biochem 1954; 158: 581-589
Klujber L, Molnár D, Kardos M, et al.: Metabolic control, glycosylated haemoglobin and high density lipoprotein cholesterol in diabetic children Eur J Pediatr 1979; 132: 289-297
Shimojo N, Kitahashi S, Naka K, et al.: Comparison of N-acetyl-ß-D-glucosaminidase and alanine aminopeptidase activities for evaluation of microangiopathy in diabetes mellitus Metabolism 1987; 36/3: 277-280
Caliskan S, Ficicioglu C, Hacibekiroglu M, et al.: Tubular markers in children with insulin-dependent diabetes mellitus Turk J Pediatr 1997; 39/2: 213-218
Platonova LV, Rabinovich SE, Shono NL, et al.: Urinary enzymes in insulin-dependent diabetes mellitus Vopr Med Chim 1996; 42/1: 70-76
Maisam A, Sitzmann FC, Strohleim S.: N-acetyl-ß-D-glucosaminidase (3-NAG) in urine: a parameter for early detection of diabetogenic nephropathy in childhood Paediatr Paedol 1993; 28/3: 77-80
Hsiao PH, és mtsai.: Urinary N-acetyl-ß-Dglucosaminidase activity in children with insulin-dependent diabetes mellitus Am J Nephrol 1996; 16/4: 300-303
* Levélcím: Dr. V. Oláh Anna
DOTE Gyermekklinika
H-4012 Debrecen, Pf.: 32